Meu filho Michael, 12, atualmente encontra-se na fase lógica e é próprio desta idade ser curioso quanto à forma como funcionam as coisas, do que são feitas, para que servem, como explicá-las ou defini-las. No primeiro semestre deste ano, dedicou-se a estudar a ciência da Química. Gostou tanto dos assuntos estudados que compôs o artigo a seguir apresentando um pouco do que aprendeu sobre o tema.

Michael Hellmann, 12 anos.
A Química é a ciência que estuda os elementos componentes dos corpos, os fenômenos que metamorfoseiam a sua composição, as leis da afinidade a partir das quais se efetuam as combinações e decomposições, as análises e sínteses.
Para melhor compreender essa definição geral é essencial compreender o que significa cada uma de suas partes. Assim definimos elemento como uma substância que não pode ser quimicamente separada em outros elementos e não pode ser produzida combinando dois ou mais elementos; fenômeno, qualquer alteração na composição de uma substância; e, por afinidade, entende-se a energia libertada quando um átomo em estado gasoso recebe um elétron.
Mas o que vem a ser “átomo”, “matéria” e “espaço”? Entende-se por átomo a menor unidade de matéria possível; por matéria, tudo o que possui massa e ocupa espaço; por massa a quantidade de matéria em um objeto; por espaço, o intervalo entre dois pontos.
Estudar química é compreender cada um de seus componentes, cada partícula individual, e é essencial definir cada uma de suas partes de forma clara e precisa. Um átomo é composto por prótons, elétrons e nêutrons. Um próton é uma partícula de carga elétrica positiva. Um nêutron é uma partícula neutra, ou seja, que não tem carga elétrica. Um elétron é uma partícula de carga negativa e de massa muito pequena. Por exemplo, um átomo de lítio é formado por 3 prótons, 3 elétrons e 4 nêutrons.
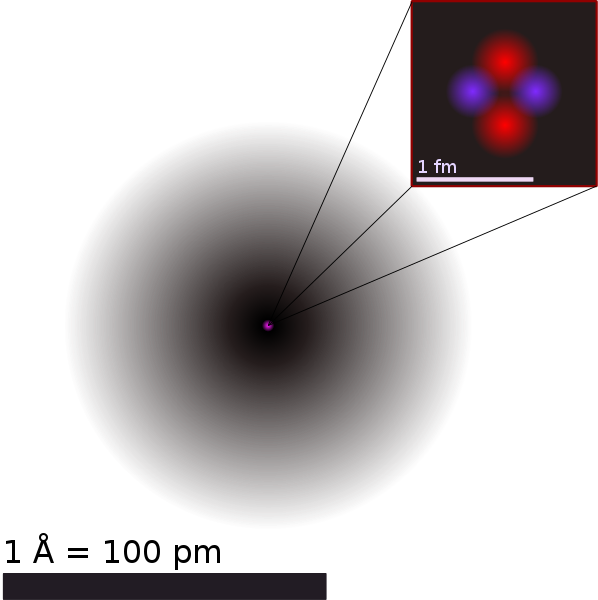
Estrutura de um átomo de Hélio. Fonte: https://commons.wikimedia.org/wiki/File:Helium_atom_QM.svg
Todos os elementos químicos conhecidos estão contidos na Tabela Periódica, criada pelo cientista russo Dmitri Mendeleev em 1869. Cada elemento é associado a um símbolo químico, composto por uma ou duas letras, sendo a primeira sempre maiúscula e, a segunda, minúscula. Acima do símbolo químico está o número atômico (o número de prótons que um átomo contêm). Abaixo do símbolo está o nome do elemento. E abaixo do nome está a massa atômica (massa média de um átomo).
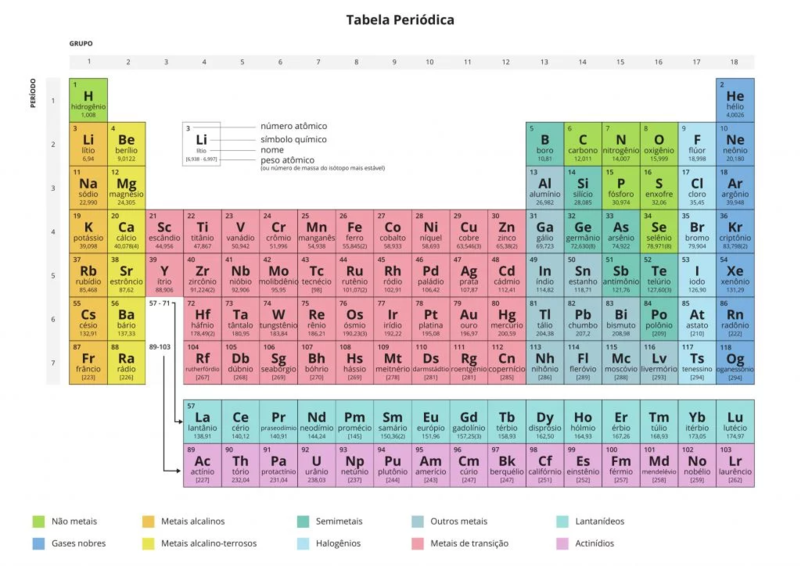
Tabela Periódica. Fonte: https://pt.wikipedia.org/wiki/Ficheiro:Tabela_Peri%C3%B3dica_de_2019.webp
A seguir destacamos alguns cientistas que muito contribuíram para o desenvolvimento desta ciência:

Robert Boyle. Fonte: https://commons.wikimedia.org/wiki/File:Robert_Boyle_0001.jpg
Robert Boyle (Lismore, Waterford, 25 de janeiro de 1627 — Londres, 31 de dezembro de 1691.) Foi um químico e estudante da Bíblia. Ele definiu o que é um elemento químico.

Lavoisier. Fonte: https://commons.wikimedia.org/wiki/File:David_-_Portrait_of_Monsieur_Lavoisier_(cropped).jpg
Antoine Laurent Lavoisier (Paris, 26 de agosto de 1743 — Paris, 8 de maio de 1794): Nobre e químico francês. Ele criou uma tabela com 33 elementos que daria inspiração à atual tabela periódica.

Pierre e Marie Curie no laboratório. Fone: https://commons.wikimedia.org/wiki/File:Pierre_and_Marie_Curie.jpg
Marie Curie (Varsóvia, 7 de novembro de 1867 — Passy, 4 de julho de 1934): Química e física polonesa. Ela descobriu vários elementos, como o Polônio; e revelou que o Tório era radioativo. Curie levantou a hipótese de que a radiação não era corolário da interação entre moléculas, mas seria proveniente do próprio átomo.
Artigo por Michael Hellmann, 12 anos.
Fontes:
O grande livro de ciências do Manual do Mundo. Rio de Janeiro: Sextante, 2019.
Tiner, John Hudson. Exploring the world of Chemistry. Master Books, 2001.

